Équipe Francastel
Méthylation de l’ADN et ARNs non-codants en physiopathologie

Zoom de groupe
Les 4 membres actuels de l’équipe Francastel: Claire Francastel, DR2 INSERM; Florent Hubé, CRCN CNRS; Guillaume Velasco, MCU Université Paris Cité; Katia Boyarchuk, Ingénieur CNRS.
© EDC
L’intérêt général des travaux de notre équipe concerne la multiplicité et la complexité des réseaux de régulation qui contrôlent l’expression et le maintien des génomes de mammifères, depuis le contrôle transcriptionnel ou épigénétique au niveau local jusqu’à l’organisation génomique globale dans le volume nucléaire. Les génomes des eucaryotes complexes étant transcrits de manière relativement généralisée, alors qu’ils sont constitués principalement de séquences qui ne contiennent pas d’information codante pour des protéines, une tâche importante de la biologie moderne consiste à documenter cette énorme production transcriptionnelle non codante et à comprendre sa pertinence fonctionnelle dans les réseaux de régulation qui contrôlent le destin cellulaire normal. Nos travaux visent particulièrement à déterminer si les perturbations de cette production non codante représentent une force motrice dans l’émergence de maladies et à identifier les mécanismes et facteurs responsables de son maintien dans les cellules normales. Au cours des dernières années, nous nous sommes concentrés sur des régions génomiques intrinsèquement non codantes qui représentent une large fraction des génomes de mammifères, c’est-à-dire les séquences répétées et les introns, comme paradigmes pour apporter des réponses à ces questions et comme cibles non conventionnelles des perturbations post-transcriptionnelles et épigénétiques caractéristiques de nombreuses maladies humaines.
– documenter la production transcriptionnelle non codante des régions mentionnées dans des situations normales et physiopathologiques
– caractériser la biogenèse des transcrits produits, leur maturation, leur régulation épigénétique, leur localisation sub-cellulaire et leurs complexes associés
– comprendre si et comment leur dérégulation représente une force motrice dans la maladie
– fournir une vue intégrée pan-génomique des défauts épigénétiques, transcriptionnels et d’épissage dans le contexte de défauts pathologiques de la machinerie de méthylation de l’ADN
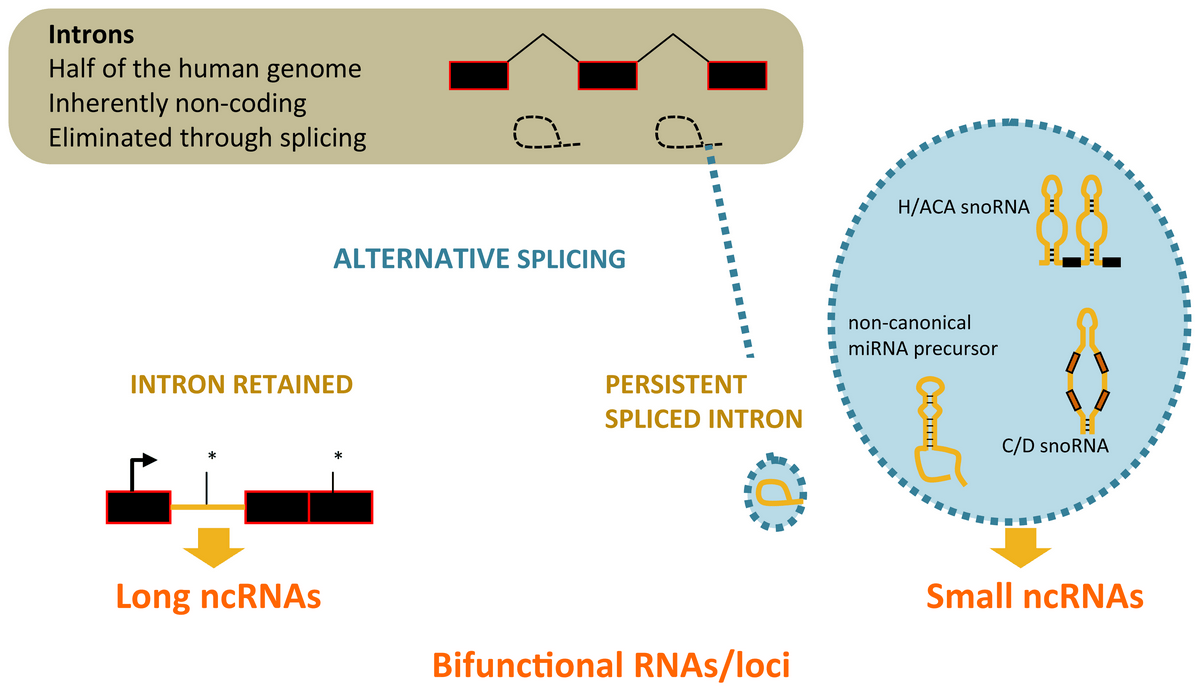
Épissage alternatif des introns et diversification de la production transcriptionnelle
Un paradigme pour tester la fonctionnalité des régions génomiques non codantes pour des protéines
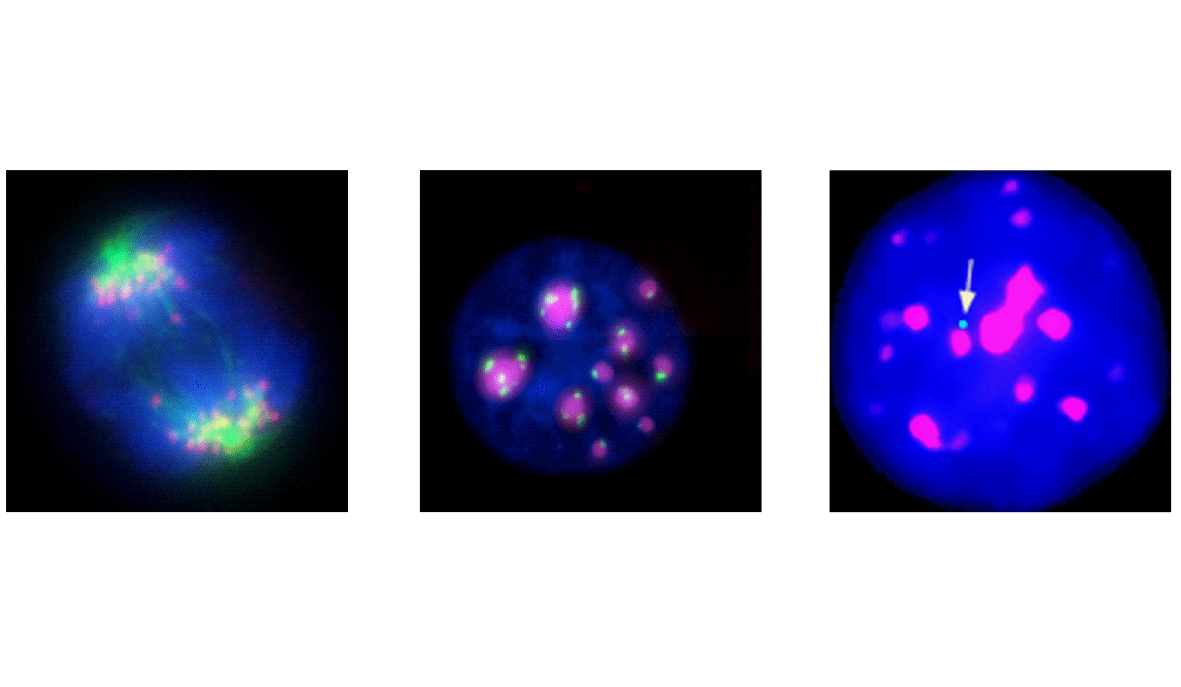
Transcription des séquences répétées centromériques
Un paradigme pour lier la transcription des séquences répétées de l’ADN à des effets moléculaires et cellulaires globaux
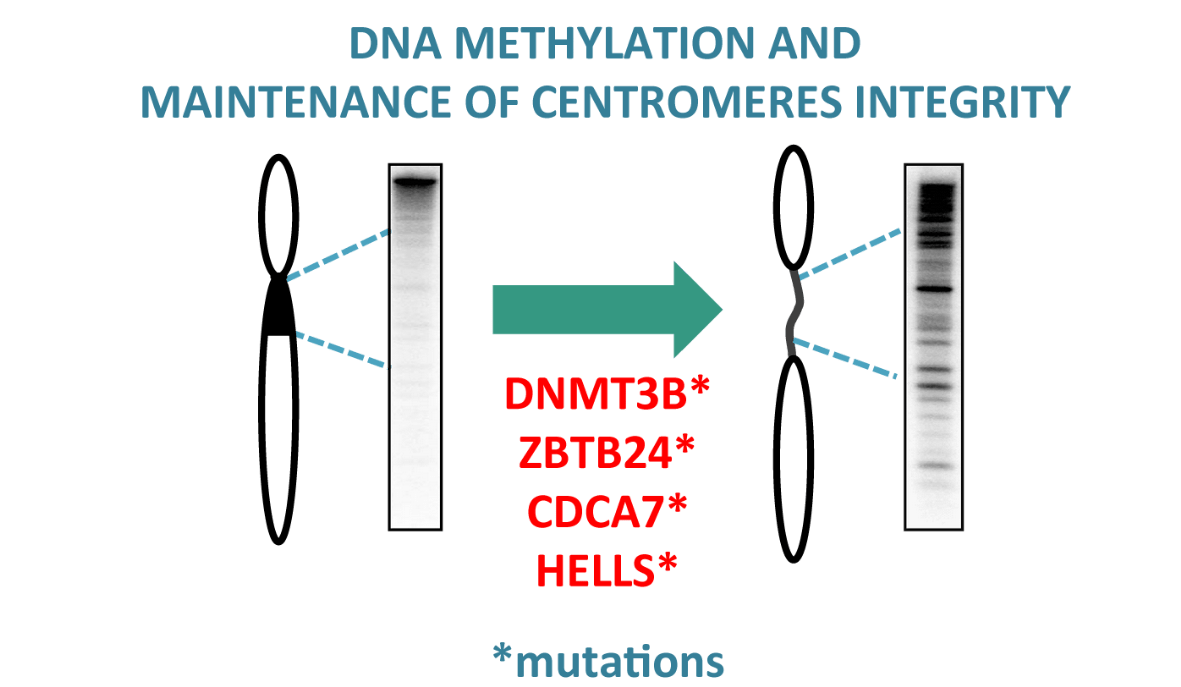
Méthylation de l’ADN et maintien de l’intégrité des génomes eucaryotes
Lorsque l’étude d’une maladie rare apporte un nouvel éclairage sur le domaine de la méthylation de l’ADN
Publications
Contact
Membres
À lire aussi

Bienvenue à Orlane
Aujourd'hui, nous accueillons un nouveau membre dans l'équipe : Orlane. Elle est étudiante en première année du Brevet de Technicien Supérieur Biotechnologies en Recherche et Production.Orlane travaillera avec Jérémy sur la fonction et la caractérisation des protéines...

Financements de 4e année de thèse pour Anaëlle
Félicitations à Anaëlle Azogui pour l’obtention de financements de 4e année de thèse par la fondation ARC (fondation pour la recherche sur le cancer). À lire aussi

Félicitations à l’équipe Defossez pour leur article publié dans Nature Communication
Félicitations à l’équipe Defossez pour leur article “DNA methylation protects cancer cells against senescence” de Chen, Yamaguchi, et al., qui a été accepté dans Nature Communication. Lire l'article : doi: https://doi.org/10.1101/2024.08.23.609297 ...

Bienvenue à Delphine, nouvelle post-doctorante dans l’équipe!
Delphine rejoint le laboratoire en tant que post-doctorante. Elle a réalisé sa thèse au Centre de Recherche en Cancérologie de Lyon (CRCL) sous la direction de Virginie Petrilli. Ses travaux de doctorat ont porté sur la protéine pro-inflammatoire NLRP3, dont elle a...
