Équipe Djeghloul
Mémoire Mitotique et Identité Cellulaire
Notre équipe étudie comment l’identité cellulaire et la mémoire épigénétique sont maintenues ou altérées au cours de la division cellulaire, en particulier lors de la mitose, dans un contexte de pluri/multipotence et de la lignée lymphoïde B humaine. Cette question fondamentale représente un défi majeur en biologie cellulaire, avec des implications clé pour la santé humaine et les maladies.
Les lymphocytes B sont générés à partir de cellules souches hématopoïétiques (CSHs) multipotentes grâce à une succession de programmes de restriction, de détermination cellulaire et de spécialisation, qui se déroulent sur plusieurs cycles de division cellulaires au cours de leur maturation. Le maintien stable de l’identité lymphoïde B au cours de la différenciation des CSHs est essentiel pour assurer une production continue et une fonction adéquate des lymphocytes B, garantissant l’intégrité du système immunitaire tout au long de la vie. Toute perturbation de ce processus peut conduire à des désordres immunologiques et à des hémopathies malignes.
Lors de la division cellulaire, les informations génétiques et épigénétiques doivent être copiées et fidèlement transmises aux cellules filles nouvellement formées. Pendant la mitose, la chromatine subit des modifications drastiques : les chromosomes se condensent fortement, la transcription est largement réduite, et de nombreux facteurs se liant à l’ADN sont exclus des chromosomes mitotiques condensés. La mitose constitue ainsi un environnement chromatinien particulièrement contraignant pour le maintien de l’identité cellulaire. Bien que de nombreux facteurs associés à l’ADN perdent leur capacité de liaison génomique pendant la mitose, certains parviennent à rester accroché et à occuper ‘du moins’ une partie des sites génomiques liés en interphase : un phénomène appelé « mitotic bookmarking ». Ces facteurs contribuent à rétablir les programmes transcriptionnels dans les cellules filles, assurant ainsi la transmission fidèle de l’identité cellulaire. Ce concept a été principalement exploré dans les cellules souches embryonnaires, qui nécessitent un équilibre constant entre maintien de l’identité et plasticité. Les besoins en termes de mémoire cellulaire peuvent donc différer dans des cellules plus différenciées (spécialisées), qui requièrent un maintien stable de leur identité tout au long de la vie afin de garantir la stabilité de lignage et la spécificité fonctionnelle. A côté de ces des facteurs ‘activateur’ avec une capacité de liaison directe à l’ADN, il devient également évident que l’état chromatinien sous-jacent – incluant les composantes répressives de l’hétérochromatine – constitue un paramètre clé pour maintien de la mémoire cellulaire.
Pour élucider de manière systématique et non biaisée les bases moléculaires de la mémoire cellulaire, le laboratoire met en œuvre des approches innovantes combinant tri de chromosomes mitotiques et analyses de protéomique et multi-omiques à haut débit. Cela permet une évaluation quantitative des protéines liées à l’ADN, mais aussi des modifications épigénétiques et des ARN associés à la chromatine mitotique native, ainsi que l’étude fonctionnelle de leur rôle dans la mémoire transcriptionnelle et épigénétique. Notre objectif est de décrypter les mécanismes moléculaires qui assurent le maintien stable de l’identité du lignage lymphoïde B au cours de la division cellulaire et de comprendre leur impact sur la régulation des gènes immunitaires et la fonction des cellules B.
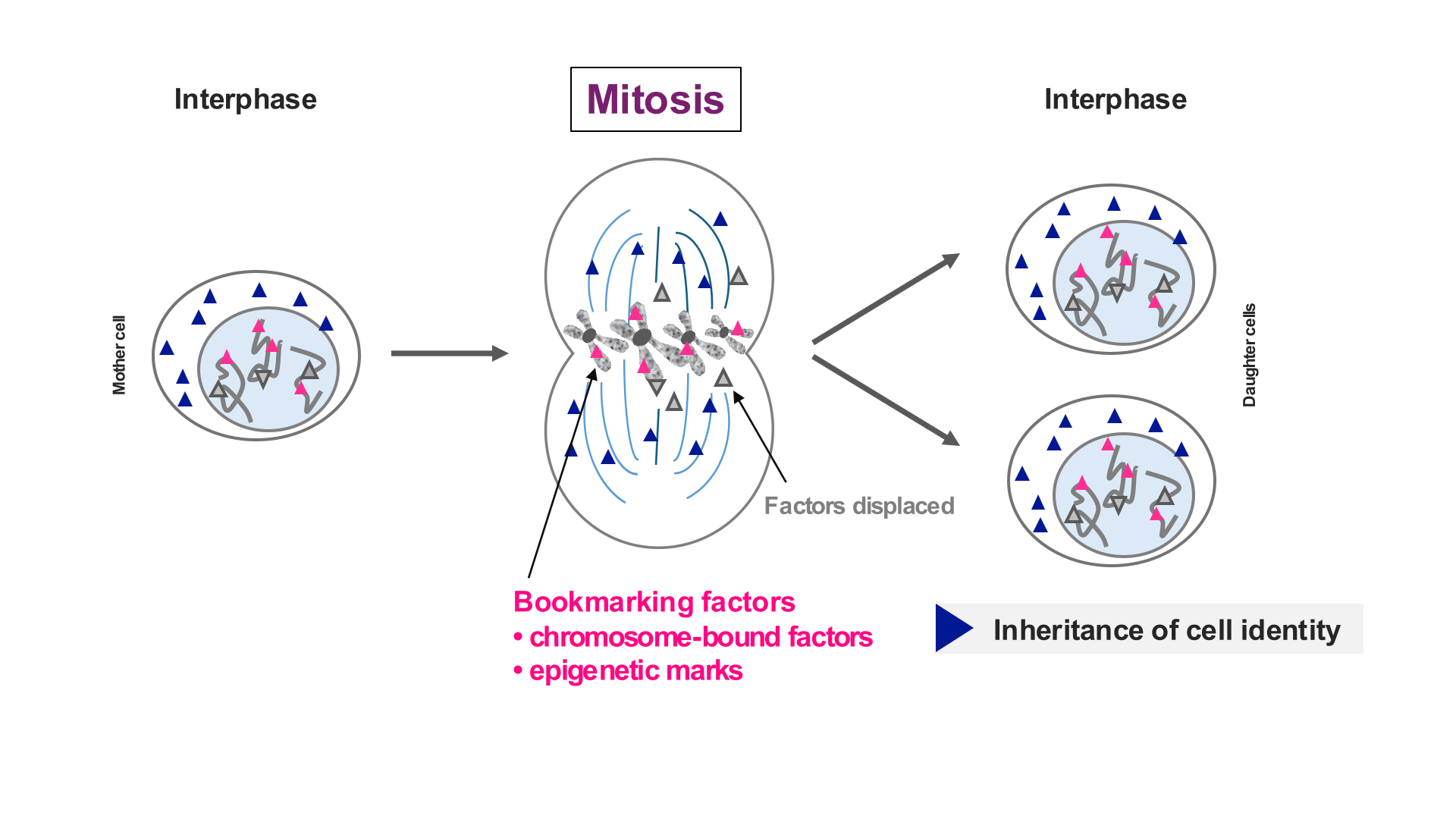
Nos projets de recherche :
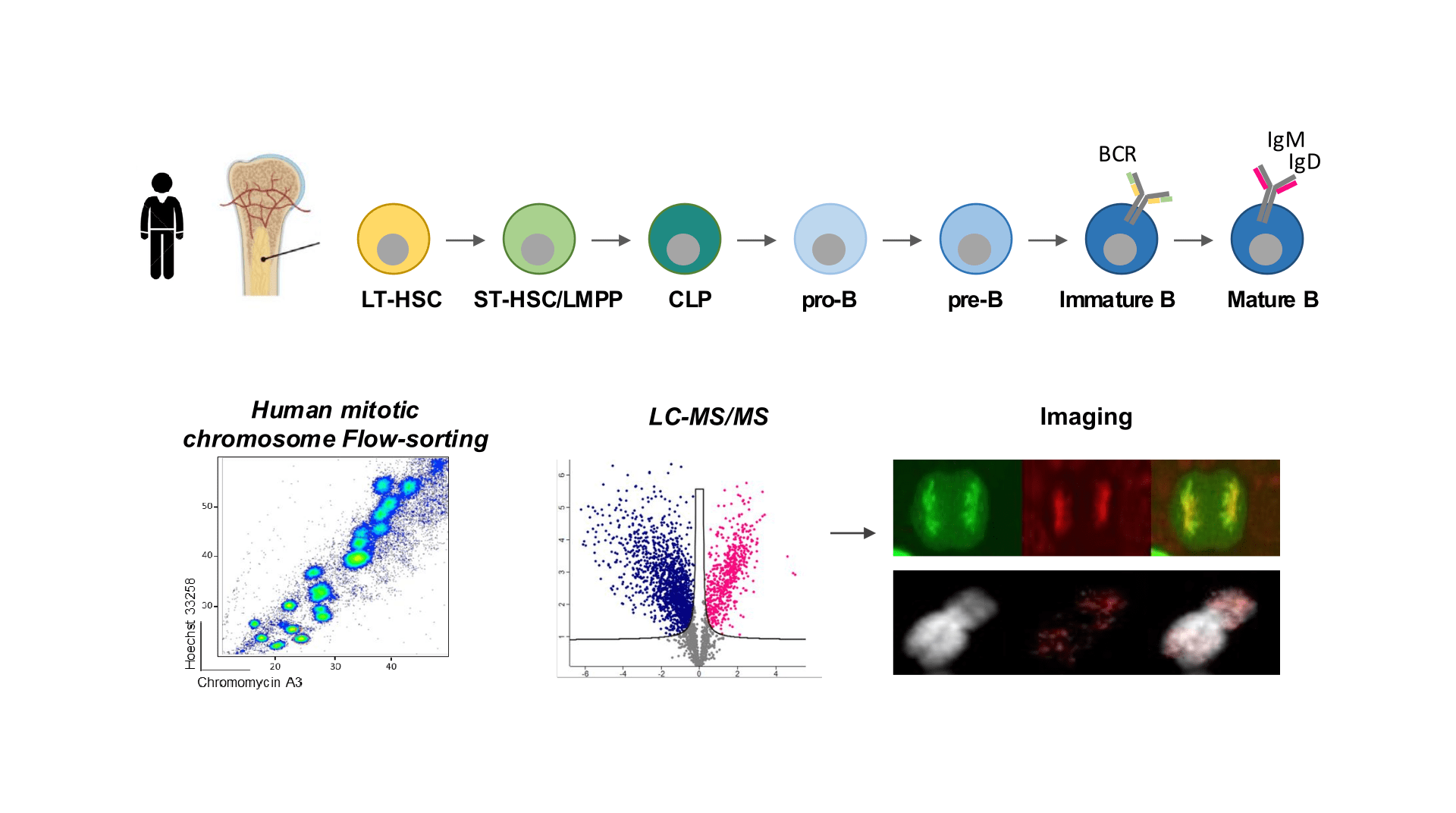
Identifier les facteurs du maintien de l’identité lymphoïde B au cours de la mitose
Description
La différenciation lymphoïde B comme modèle pour étudier la mémoire mitotique dans le contexte de l’engagement de l’identité cellulaire et de la différenciation.
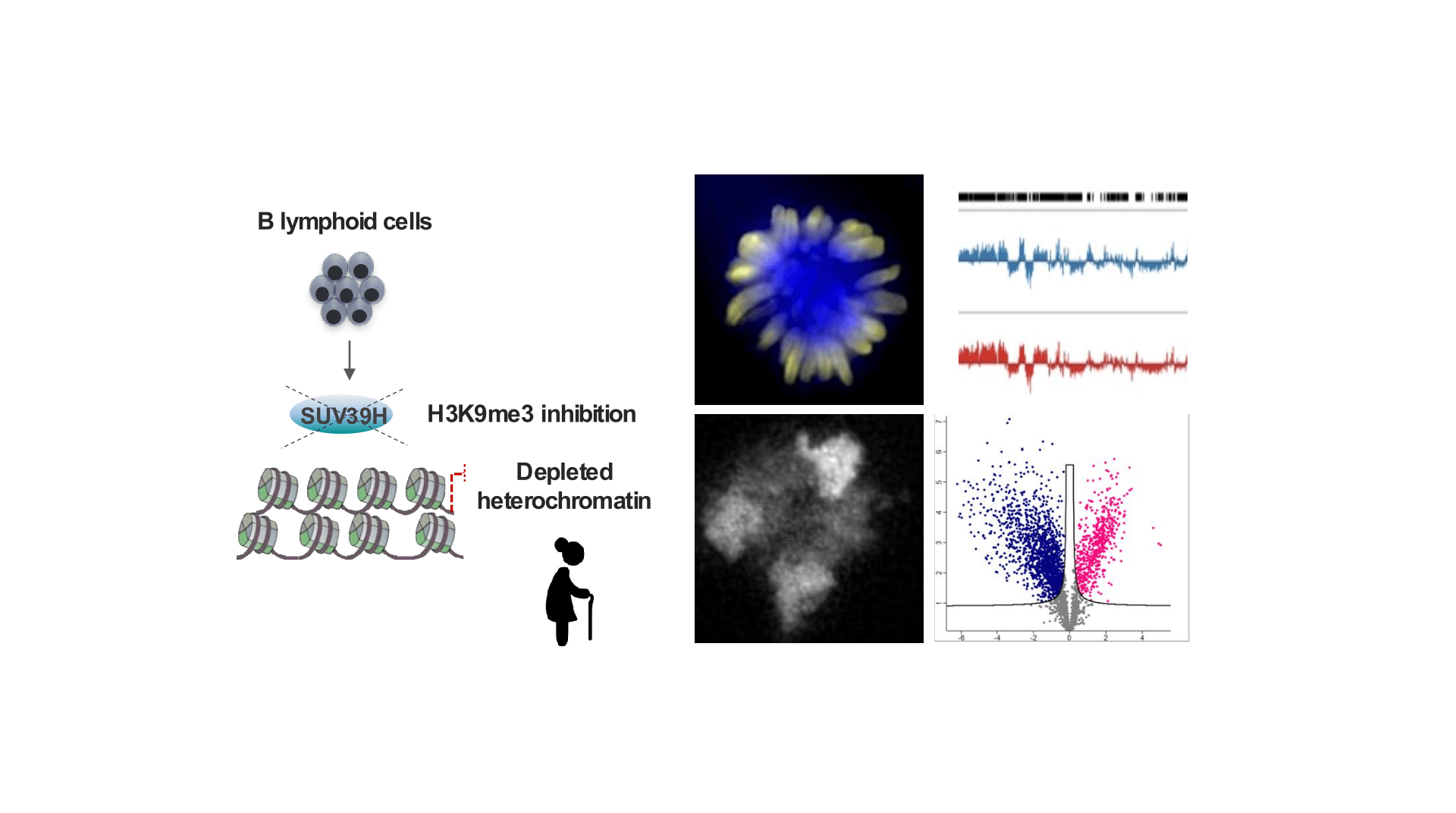
Interdépendance entre l’état de la chromatine et la mémoire cellulaire
Description
- Rôle de H3K9me3 dans la transmission de l’identité du lignage lymphoïde B
- Impact des modifications de l’hétérochromatine liées à l’âge sur l’identité cellulaire et la fidélité génomique au cours de la lymphopoïèse B normale et pathologique
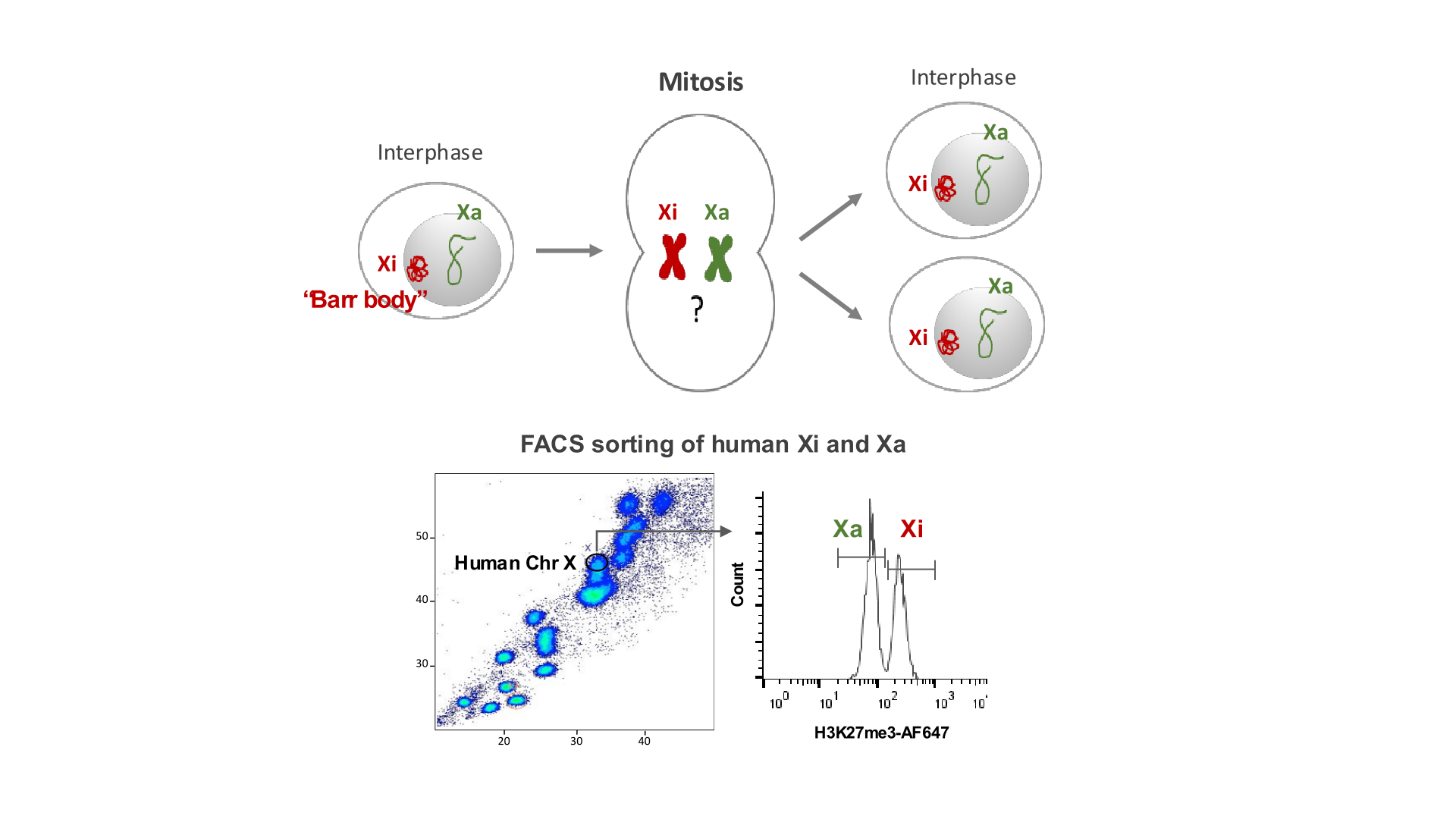
Étude de la mémoire épigénétique du chromosome X dans les lymphocytes B
Description
Le chromosome X contient un grand nombre de gènes impliqués dans l’inflammation et l’immunité, et il est de plus en plus démontré que le maintien de l’inactivation du chromosome X (ICX) est essentiel au bon fonctionnement des voies immunitaires et au développement des lymphocytes B. L’ICX constitue un paradigme de l’héritage épigénétique et offre une opportunité unique pour étudier comment les signatures épigénétiques sont propagées de façon clonale à travers la division cellulaire et restaurées dans les cellules filles.
Au laboratoire, nous utilisons le tri de chromosomes pour isoler les chromosomes X actif et inactif humains à partir de lymphocytes B, identifier leurs facteurs liés à la chromatine, et analyser leur rôle dans le dosage des gènes immunitaires liés à l’X et la réponse immunitaire sexuellement biaisée.
Publications
PUBLICATIONS:
DJEGHLOUL D*, Cheriyamkunnel S, Patel B, Kramer H, Montoya A, Brown KE, Whilding C, Nesterova T, Wei G, Brockdorff N, Grządzielewska I, Karayol R, Akhtar A, Merkenschlager M and Fisher AG*. Hbo1 and Msl complexes preserve differential compaction and H3K27me3 marking of active and inactive X chromosomes during mitosis. Nat Cell Biol. 2025. Sep;27(9):1482-1495. doi: 10.1038/s41556-025-01748-0. PMID: 40921734
Dimond A, Gim DH, Ing-Simmons E, Kramer H, DJEGHLOUL D, Montoya A, Patel B, Cheriyamkunnel S, Brown KE, Shliaha P, Vaquerizas JM, Merkenschlager M and Fisher AG*. PBK/TOPK mediates Ikaros, Aiolos and CTCF displacement from mitotic chromosomes and alters chromatin accessibility at selected C2H2-zinc finger protein binding sites. Nat Commun. 2025. Sep 23;16(1):8348. doi: 10.1038/s41467-025-63740-4. PMID: 40987773
DJEGHLOUL D*, Dimond A, Cheriyamkunnel S, Kramer H, Patel B, Brown K, Montoya A, Whilding C, Wang YF, Futschik ME, Veland N, Montavon T, Jenuwein T, Merkenschlager M, Fisher AG*. Loss of H3K9 tri-methylation impacts mitotic chromosome compaction and transcription factor retention. Nat Struct Mol. 2023. Apr;30(4):489-501. doi: 10.1038/s41594-023-00943-7. PMID: 36941433.
DJEGHLOUL D, Patel B, Kramer H, Dimond A, Whilding C, Brown K, Kohler AC, Feytout A, Veland N, Elliott J, Bharat TAM, Tarafder AK, Löwe J, Ng BL, Guo Y, Guy J, Huseyin MK, Klose RJ, Merkenschlager M, Fisher AG*. Identifying proteins bound to native mitotic ESC chromosomes reveals chromatin repressors are important for compaction. Nat Commun. 2020. Aug 17;11(1):4118. doi: 10.1038/s41467-020-17823-z. PMID: 32807789.
Cuartero S, Weiss FD, Dharmalingam G, Guo Y, Ing-Simmons E, Masella S, Robles-Rebollo I, Xiao X, Wang YF, Barozzi I, DJEGHLOUL D, Amano MT, Niskanen H, Petretto E, Dowell RD, Tachibana K, Kaikkonen MU, Nasmyth KA, Lenhard B, Natoli G, Fisher AG, Merkenschlager M*. Control of inducible gene expression links cohesin to hematopoietic progenitor self-renewal and differentiation. Nat Immunol. 2018. Sep;19(9):932-941. doi: 10.1038/s41590-018-0184-1. PMID: 30127433.
DJEGHLOUL D, Kuranda K, Kuzniak I, Barbieri D, Naguibneva I, Choisy C, Bories JC, Dosquet C, Pla M, Vanneaux V, Socié G, Porteu F, Garrick D, Goodhardt M. Age-Associated Decrease of the Histone Methyltransferase SUV39H1 in HSC perturbs heterochromatin and B lymphoid differentiation. Stem Cell Reports. 2016. Jun 14;6(6):970-984. doi: 10.1016/j.stemcr.2016.05.007. PMID: 27304919.
Lescale C#, Schenten V#, DJEGHLOUL D, Bennabi M, Gaignier F, Vandamme K, Strazielle C, Kuzniak I, Petite H, Dosquet C, Frippiat JP, Goodhardt M. Hind limb unloading, a model of spaceflight conditions, leads to decreased B lymphopoiesis similar to aging. FASEB J. 2015. Feb;29(2):455-63. doi: 10.1096/fj.14-259770. PMID: 25376832.
Armand AS, Laziz I, DJEGHLOUL D, Lécolle S, Bertrand AT, Biondi O, De Windt LJ, Chanoine C. Apoptosis-inducing factor regulates skeletal muscle progenitor cell number and muscle phenotype. PLoS press. 2011. 6(11):e27283. doi: 10.1371/journal.pone.0027283. PMID: 22076146.
BOOK CHAPTERS:
Garrick D, David A, Freitas C, DJEGHLOUL D, Goodhardt M. Noncoding RNA and Epigenetic Change in Hematopoietic Stem Cell Aging. Springer International Publishing, Handbook of Immunosenescence, 2019, p. 1011-1038, doi: 10.1007/978-3-319-99375-1_99.
Garrick D, DJEGHLOUL D, Kuranda K, Goodhardt M. Aging of Human Haematopoietic Stem Cells. Springer, Stem Cell Aging: Mechanisms, Consequences, Rejuvenation, 2015, p. 127-147, doi : 10.1007/978-3-7091-1232-8_7.
Contact
Dounia Djeghloul
dounia-zede.djeghloul@cnrs.fr
Membres
Financements
Ici les noms des financeurs de l’équipe
À lire aussi

Bienvenue à Léa
Léa rejoint l’équipe en tant qu’ingénieure d’études. Après un master en virologie, elle a travaillé à Strasbourg sur les virus de la vigne, puis sur la caractérisation de la dégradation des ARNm chez les plantes à l’Institut de biologie moléculaire des plantes (IBMP)....

Sophie Polo reçoit un financement Impulscience® de la Fondation Bettencourt Schueller
Sophie Polo a reçu un financement Impulscience® pour financer un projet de recherche sur l'établissement et le maintien du chromosome X inactif en réponse aux cassures de l'ADN. C'est une formidable nouvelle pour le laboratoire! Nous remercions la Fondation...
Quand retirer une étiquette de l’ADN stoppe la croissance tumorale
Chez les mammifères, la méthylation de l’ADN est une petite modification chimique qui agit comme une étiquette sur certaines bases de l’ADN, les cytosines. Elle n’altère pas la séquence mais participe au contrôle de l’activité des gènes et la stabilité du génome. Dans...

Bienvenue à Léa, nouvelle ingénieure d’études dans l’équipe!
Léa rejoint l'équipe en tant qu'ingénieure d'études. Titulaire d'un Master en biologie moléculaire et cellulaire de Sorbonne Université, Léa va contribuer à un projet de recherche visant à disséquer les mécanismes de maintien de la méthylation de l'ADN en réponse aux...



